Casi Clinici [DIABETE] Il profilo glicemico è caratterizzato da eccessive escursioni nel periodo post-prandiale (2008) |  |
Obiettivi
-
Rimarcare l’importanza del buon controllo della glicemia post-prandiale.
-
Rimarcare l’importanza della personalizzazione della terapia insulinica.
Caso clinico: 1° step
MF è un uomo di 58 anni, altezza 177 cm, peso 83 kg, indice di massa corporea (body mass index [BMI]) 26,5 kg/m2, sposato, di professione magazziniere. Non pratica attività motoria in maniera regolare ed è obbligato a utilizzare il proprio automezzo per recarsi al lavoro dal lunedì al venerdì.
MF è diabetico da 9 anni (diagnosi di diabete tipo 2 all’età di 49 anni), complicato da retinopatia background e ipertensione arteriosa (diagnosi all’età di 53 anni) controllata con ACEinibitore.
Dopo il fallimento di un breve periodo di sola terapia dietetica, MF è stato posto in trattamento con sulfoniluree (intolleranza alla metformina) ottenendo un discreto controllo glicemico nei due anni successivi. Dall’età di 53 anni si è assistito a un progressivo deterioramento del controllo glicemico nonostante la titolazione al dosaggio massimo della sulfonilurea e l’aggiunta di inibitori delle alfa-glucosidasi.
L’aggiunta d’insulina NPH (neutral protamine hagedorn) bed-time (sino a 12 UI) ha consentitoun miglioramento della glicemia a digiuno, mal’emoglobina glicosilata (HbA1c) è rimasta insoddisfacente (8,2-8,9%).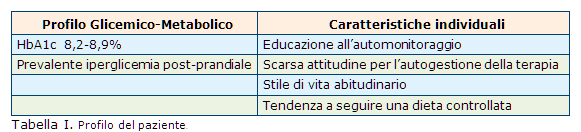
Il paziente effettua con regolarità l’automo-nitoraggio domiciliare della glicemia, ma è poco propenso a effettuare modifiche del dosaggio insulinico di propria iniziativa. Effettua tutti i pasti a casa e riferisce di essere molto attento alla dieta prescritta e agli orari di assunzione dei pasti (vedere profilo del paziente in Tab. I).
Data la necessità di intensificare il trattamento, econsiderando le caratteristiche individuali del
paziente, viene istituita terapia con insulina umana premiscelata (30/70) due volte al giornoe,in seguito, applicato l’attuale schema ditriplice somministrazione insulinica:
-
umana regolare 10 UI a colazione;
-
umana regolare 14 UI a pranzo;
-
umana premiscelata 30/70
 18 UI a cena.
18 UI a cena.
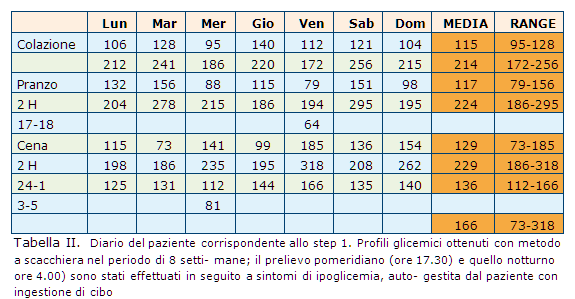
Le suddette modifiche dello schema terapeutico hanno consentito di migliorare il compenso metabolico generale (HbA1c 7,5%) senza però raggiungere i target raccomandati. MF si presenta al controllo di routine lamentando un’eccessiva variabilità nei valori glicemici riscontrati tramite autocontrollo (Tab. II).
In particolare ha osservato:
-
erglicemia post-prandiale non modificata dall’aumento di 2 UI di insulina a colazione e 4 a pranzo;
-
sintomatologia riferibile a ipoglicemia nella tarda mattinata, fenomeno accentuato dall’aumento del dosaggio insulinico;
-
evenienza di crisi ipoglicemiche nel tardo pomeriggio dopo l’incremento dell’insulina a pranzo (8 episodi in 1 mese);
-
modesto incremento ponderale (1 kg);
-
rare ipoglicemie notturne (1 ogni 3 settimane in media).
Domanda
Quando si è resa necessaria l’intensificazione della terapia insulinica, perché si è scelto di passare dalla monosomministrazione di insulina basale a uno schema terapeutico a iniezioni multiple giornaliere (MDI) con insuline premiscelate piuttosto che con basal/ bolus? 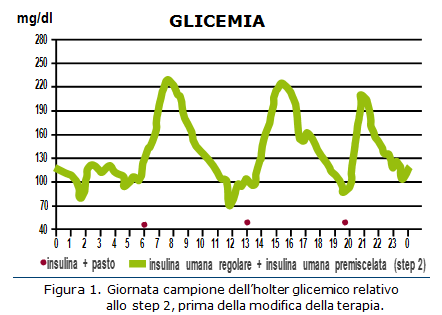
Risposta
Il compenso glicemico non soddisfacente del paziente, nonostante un discreto controllo della glicemia a digiuno, suggerisce la necessità di intensificare il trattamento allo scopo di ottenere anche un buon controllo glicemico nel periodo postprandiale 1. Le caratteristiche personali del paziente, che dimostra una scarsa attitudine per l’autogestione della terapia, possiede uno stile di vita abitudinario, con tendenza a seguire una dieta controllata, permettono l’imple-mentazione di uno schema terapeutico a iniezioni multiple (MDI) limitato a due o tre somministrazioni giornaliere.
Caso clinico: 2° step
Sulla base delle informazioni raccolte nello step 1, viene programmata registrazione continua della glicemia tramite holter per 72 ore, effettuata dopo 7 giorni. La registrazione holter (Fig. 1) conferma quanto evidenziato dal monitoraggio domiciliare, ovvero l’eccessivo picco glicemico post-prandiale con tardiva normalizzazione dei valori glicemici e tendenza all’ipoglicemia pre-prandiale. Emerge inoltre che nei giorni lavorativi, per motivi pratici e per paura di ipoglicemie, il paziente effettua la somministrazione insulinica immediatamente prima dei pasti. Nei giorni festivi il paziente anticipa l’iniezione di 10-15 minuti. Dal colloquio si evidenzia anche un’assunzione di carboidrati a colazione lievemente superiore alla dose raccomandata. Le informazioni raccolte portano a modificare le raccomandazioni per il paziente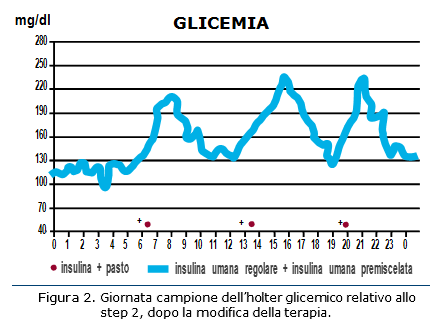 nel modo seguente:
nel modo seguente:
-
si ripristinano i dosaggi originari di insulina (10 + 14 + 18);
-
si chiede al paziente di anticipare l’iniezione 30 minuti prima del pasto in forma costante approfittando di un periodo di ferie;
-
si riduce l’apporto di carboidrati a colazione; Viene programmato un nuovo controllo della glicemia con misurazione continua sottocutanea (CGMS) dopo 2 settimane (Fig. 2).
Domanda
L’intervento sullo stile di vita del paziente ha permesso di compensare significativamente i difetti del suo profilo glicemico?
Risposta
L’insulina umana, somministrata per via sottocutanea, ha un inizio d’azione ritardato di circa 30-40 minuti rispetto al momento dell’iniezione e inoltre il profilo farmacocinetico è caratterizzato da un picco inferiore alle necessità fisiologiche 2. In aggiunta, tale picco d’azione è raggiunto dopo circa 100-150 minuti 3 e la durata d’azione è spesso superiore a quella del periodo post-prandiale, contribuendo a incrementare il rischio di ipoglicemie 3.
L’utilizzo di insulina umana rende quindi necessario anticipare la somministrazione di almeno 30-45 minuti rispetto al pasto. Molti pazienti, come nel caso di MF, non rispettano tali tempistiche di somministrazione sia per motivi pratici, sia per paura delle ipoglicemie 4.
Dato che il paziente tendeva a somministrare l’insulina umana con tempistiche scorrette (amplificandone le limitazioni di cinetica), si è pensato di intervenire correggendo le abitudini del paziente. I cambiamenti introdotti nello step 2 hanno però prodotto effetti pressoché irrilevanti sulle glicemie post-prandiali.
Studi sulla somministrazione pre- e post-prandiale dell’insulina umana regolare e delle insuline umane premiscelate rispetto alle rispettive formulazioni con analoghi dell’insulina 5 6 hanno evidenziato la maggiore flessibilità di somministrazione delle formulazioni di analoghi grazie a profili farmacocinetici più sovrapponibili alle necessità fisiologiche.
Caso clinico: 3° step
Considerata la scarsa risposta in termini di miglioramento della glicemia post-prandiale, la terapia viene modificata in:
-
insulina aspart bifasica 70/30 10 U a colazione;
-
insulina aspart bifasica 70/30 14 U a pranzo;
-
insulina aspart bifasica 30/70 18 U a cena.
Viene programmata visita di controllo a 2 mesi con effettuazione di nuova registrazione con CGMS.
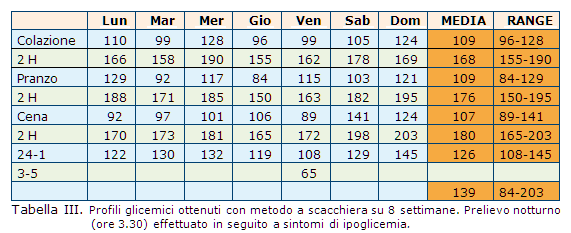
Al controllo, il paziente riferisce una migliore qualità di vita, un ridotto numero totale di episodi ipoglicemici, in particolare di quelli notturni. Il paziente non ha modificato i dosaggi in modo autonomo rispetto al controllo precedente. I dati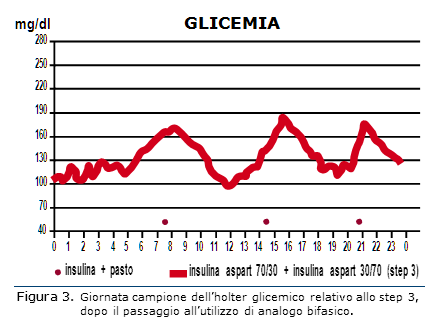 dell’automonitoraggio glicemico permettono di evidenziare un miglio-ramento del profilo glicemico (Tab. III).
dell’automonitoraggio glicemico permettono di evidenziare un miglio-ramento del profilo glicemico (Tab. III).
La registrazione holter conferma i dati dell’automonitoraggio, ovvero la sostanziale riduzione dell’iperglicemia post-prandiale e stabilizzazione del profilo (Fig. 3).
Domanda
Perché è stato scelto di sostituire l’insulina umana regolare con insulina aspart bifasica 70/30?
Risposta
Mentre i vantaggi dell’insulina aspart bifasica 30/70 rispetto all’insulina umana premiscelata sono stati dimostrati in precedenza 7 8, non esistono dati di confronto diretto tra insulina umana regolare e insulina aspart bifasica 70/30. Esistono però dati di confronto tra analogo rapido e insulina umana regolare 9 e studi di confronto tra analogo rapido e le varie formulazioni di analogo rapido protaminato.
In particolare, in uno studio randomizzato, in doppio cieco, crossover, condotto in 32 pazienti con diabete tipo 1, le farmacocinetiche dell’insulina aspart (IAsp) e delle sue varie formulazioni protaminate (70/30; 50/50; 30/70) sono state analizzate mediante clamp euglicemico dopo somministrazione di 0,4 U/kg di insulina 10.
Le concentrazioni plasmatiche di insulina aspart nelle prime due ore e nelle prime sei ore dopo la somministrazione aumentavano con l’aumentare della percentuale di insulina aspart solubile presente nella formulazione, quindi l’effetto massimo sulla glicemia (GIRmax) era maggiore per l’insulina aspart e progressivamente minore per l’insulina aspart bifasica 70/30, 50/50 e 30/70.
Analogamente, le concentrazioni plasmatiche di insulina aspart rilevate nel periodo di 12-28 ore dopo la somministrazione diminuivano progressivamente con l’aumentare della percentuale di insulina aspart solubile presente nella formulazione, quindi la durata d’azione era maggiore per l’insulina aspart bifasica 30/70 ma progressivamente e significativamente minore per l’insulina aspart bifasica 50/50, 70/30 e l’insulina aspart solubile, rispettivamente.
In sintesi, il profilo d’azione dell’insulina aspart bifasica 70/30 possiede caratteristiche intermedie tra quello dell’insulina aspart e quello dell’insulina umana regolare, con un picco d’azione che si avvicina a quello dell’analogo rapido, ma con una durata d’azione maggiore, rispetto a quest’ultimo, grazie alla presenza di una componente pari al 30% di insulina ad azione ritardata. Tali caratteristiche potrebbero suggerire, per l’insulina aspart bifasica 70/30, un impiego ottimale in situazioni in cui, per esempio, la distanza tra i pasti sia prolungata e la dieta preveda il consumo di cibi con elevato contenuto glucidico, tipico della dieta mediterranea.
Sulla base di questa considerazione, nel presente caso clinico, per cercare di contenere le eccessive escursioni glicemiche postprandiali, e nello stesso tempo mantenere il controllo glicemico interprandiale, è stato scelto di sostituire l’insulina umana regolare con insulina aspart bifasica 70/30.
Commento
La gestione del presente caso è particolarmente istruttiva perché dimostra da un lato l’utilità dell’educazione del paziente a uno scrupoloso autocontrollo, dall’altro suggerisce l’holter glicemico come alternativa all’automonitoraggio, per esempio in pazienti poco collaborativi. È importante sottolineare che il monitoraggio continuo della glicemia è eseguito da un limitato numero di Servizi di Diabetologia, essendo una procedura complessa e costosa, pertanto da ritenersi complementare e non alternativa a un adeguato automonitoraggio glicemico in casi selezionati.
La disponibilità di profili glicemici completi, ottenuti con l’automonitoraggio oppure con la registrazione continua della glicemia, nel caso qui presentato hanno permesso di evidenziare fluttuazioni glicemiche altrimenti non sospettabili sulla base di una superficiale lettura del controllo glicemico medio raggiunto dal paziente, seppure discreto (HbA1c 7,5% in corrispondenza dello step 2).
La modifica dello schema di trattamento da insulina NPH bedtime a insulina umana regolare (colazione e pranzo) + insulina umana premiscelata (30/70) alla sera ha consentito di raggiungere buoni valori a digiuno, prima di pranzo e cena. La glicemia media (166 mg/dL) era sostanzialmente in linea con la glicosilata (7,5%), ma tale media era prodotta da ampie fluttuazioni glicemiche nelle 24 ore, come dimostrato dall’importante delta di variazione glicemica dopo l’assunzione di cibo (circa 100 mg/dL fra prima e dopo i pasti) (Tab. IV, arancione).
 Le ampie escursioni glicemiche nel periodo post-prandiale rivelano un sostanziale deficit nell’apporto di insulina in corrispondenza del pasto. Tale deficit, causato dai limiti farmacocinetici delle formulazioni a base di insulina umana solubile e premiscelata, non è stato corretto neanche tramite l’ottimizzazione dei dosaggi (aumento del rischio di ipoglicemia) o delle tempistiche di somministrazione dell’insulina, ed era inoltre evidente sia in occasione della colazione e del pranzo (in corrispondenza dei quali era somministrata l’insulina umana regolare), sia in occasione della cena (in corrispondenza della quale era somministrata l’insulina umana premiscelata 30/70).
Le ampie escursioni glicemiche nel periodo post-prandiale rivelano un sostanziale deficit nell’apporto di insulina in corrispondenza del pasto. Tale deficit, causato dai limiti farmacocinetici delle formulazioni a base di insulina umana solubile e premiscelata, non è stato corretto neanche tramite l’ottimizzazione dei dosaggi (aumento del rischio di ipoglicemia) o delle tempistiche di somministrazione dell’insulina, ed era inoltre evidente sia in occasione della colazione e del pranzo (in corrispondenza dei quali era somministrata l’insulina umana regolare), sia in occasione della cena (in corrispondenza della quale era somministrata l’insulina umana premiscelata 30/70).
Le formulazioni di analoghi bifasici coniugano, in un solo prodotto, i vantaggi dell’analogo rapido dell’insulina (miglior controllo della glicemia postprandiale, somministrazione flessibile rispetto al pasto) con quelli di una formulazione premiscelata contenente anche una frazione a più lunga durata d’azione (cristalli di analogo rapido protaminato). Essi permettono perciò di iniziare e intensificare la terapia insulinica in maniera flessibile ed efficace e offrono l’opportunità di schemi semplici con un basso rischio di ipoglicemia.
Per cercare di ovviare ai suddetti limiti farmacocinetici delle insuline umane, nel presente caso clinico l’insulina umana regolare è stata quindi sostituita con insulina aspart bifasica 70/30, mentre l’insulina umana premiscelata è stata sostituita con insulina aspart bifasica 30/70.
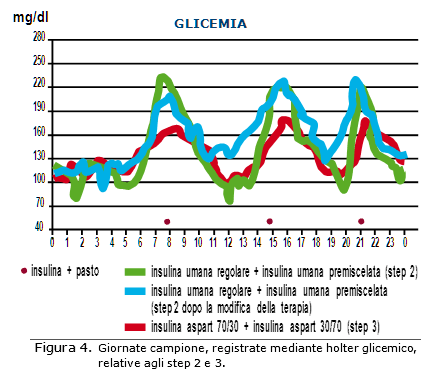
I profili ottenuti tramite il monitoraggio continuo della glicemia negli step 1, 2 e 3 sono sovrapposti in Figura 4 ed evidenziano la riduzione delle fluttuazioni glicemiche dopo il trattamento con 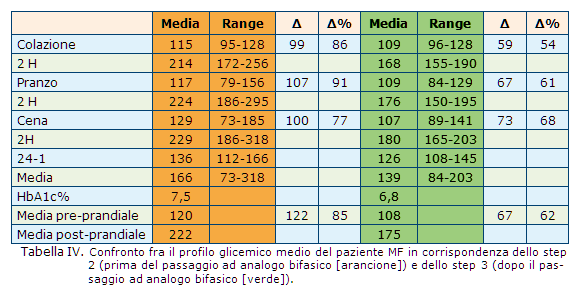 insulina aspart 70/30 + insulina aspart 30/70. La riduzione delle fluttazioni era raggiunta grazie a un migliore controllo della glicemia post-prandiale e inter-prandiale (Tab. IV, verde).
insulina aspart 70/30 + insulina aspart 30/70. La riduzione delle fluttazioni era raggiunta grazie a un migliore controllo della glicemia post-prandiale e inter-prandiale (Tab. IV, verde).
Infine, il paziente ha riferito una migliore qualità di vita, che potrebbe essere correlabile sia al contenimento delle escursioni glicemiche post-prandiali, sia alla flessibilità di somministrazione dell’analogo dell’insulina rispetto all’insulina umana.
Bibliografia
-
Monnier L, Lapinski H, Colette C. Contri-butions of fasting and postprandial plasma glucose increments to the overall diurnal hyperglycemia of type 2 diabetic patients: variations with increasing levels of HbA(1c). Diabetes Care 2003;26:881-5.
-
Barnett AH, Owens DR. Insulin analogues. Lancet 1997;349:47-51.
-
Christiansen JS. Insulin aspart: rapid control for postmeal glucose excursion. Expert Rev Endocrinol Metab 2007;2:587-97.
-
Overmann H, Heinemann L. Injection-meal interval, recommendations of diabetologists and how patients handle it. Diab Res Clin Pract 1999;43:137-42.
-
Brunner GA, Hirschberger S, Sendlhofer G, Wutte A, Ellmerer M, Balent B, et al. Post-prandial administration of the insulin analogue insulin aspart in patients with type 1 diabetes mellitus. Diabet Med 2000;17:371-5.
-
Kapitza C, Rave K, Ostrowski K, Heise T, Heinemann L. Reduced postprandial glycaemic excursion with biphasic insulin aspart 30 injected immediately before a meal. Diabet Med 2004;21:500-1.
-
Jacobsen LV, Søgaard B, Riis A. Pharmacokinetics and pharmacodynamics of a premixed formulation of soluble and protamine-retarded insulin aspart. Eur J Clin Pharm 2000;56:399-403.
-
Boehm BO, Home PD, Behrend C, Kamp NM, Lindholm A. Premixed insulin aspart 30 vs. premixed human insulin 30/70 twice daily: a randomized trial in Type 1 and Type 2 diabetic patients. Diabet Med 2002;19:393-9.
-
Brange J, Ribel U, Hansen JF, Dodson G, Hansen MT, Havelund S. Monomeric insulins obtained by protein engineering and their medical implications. Nature 1988;333:679.
-
Rave K, Heise T, Eckers U, Kanc K, Nielsen JN, Nosek L. Différentes préparations prémélangées d’insuline asparte biphasique sont caractérisées par des différences notables en termes de délai et de durée d’action. ALFEDIAM, March 2007.



